近日,国家食品药品监督管理总局发布《2016 年生物制品批签发年报》,数据显示,2016年,签发疫苗3949批、约计6.46亿人份;血液制品4025批,约计5927.80万瓶和血筛试剂836批,约计8.78亿人份。
目前,实施批签发的疫苗和血筛试剂以国产制品为主,进口制品少于 5%。血液制品因原料血浆不足,人血白蛋白临床供给存在 50%以上缺口,依靠进口人血白蛋白补充。批签发制品的生产规范性较好、质量稳定可控,近年来不合格制品少。2016 年仅有 1 批国产疫苗和 2 批进口人血白蛋白不符合规定。
2016 年度疫苗批签发概况
2016 年,疫苗签发 51 个品种、共 3950 批次,其中 3949 批符合规定。1 批不符合规定(不合格率为 0.25‰)。拒签的 1 批疫苗(210048 人份)为长春长生生物科技股份有限公司生产的吸附无细胞百白破联合疫苗,不合格项目为无细胞百日咳疫苗效价测定。其中,中检院批签发涉及全部 51 个疫苗品种、共 3931 批次;上海市食品药品检验所仅签发流感病毒裂解疫苗一个品种的共 19 批(2.16 百万人份),结果均符合规定。详细数据见附件 1。
通过数据分析归纳如下:
1.疫苗质量稳定,不合格制品较少
近年来,疫苗批签发不合格率较低,2016 年为 0.03%。历年不合格率均低于 0.5%(2015年除外,因辽宁依生公司申请复审的狂犬病疫苗和乙脑灭活疫苗共 181 批被拒签,拉升当年不合格率达 4.2%)。
2.疫苗签发量总体有下降趋势,2016 年较 2015 年无明显差异
通过分析 2010 年至 2016 年疫苗批签发数据,反映出:一是疫苗品种稳定。历年疫苗品种数基本持平,在 50 种左右。
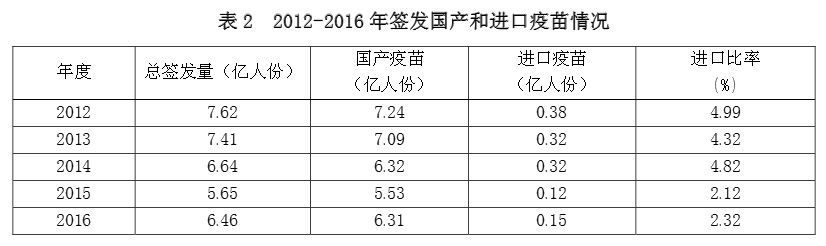
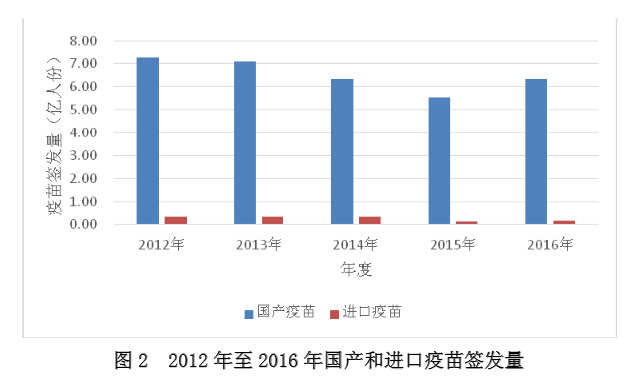
二是批签发批次呈下降趋势。2010 至2013 年每年 5000 批左右,近三年每年 4000 批左右。与 2015 年比较,2016 年虽总批次略有下降,但总体签发量并未减少,约计 6.46 亿人份。
3.上市疫苗以国产疫苗为主,进口疫苗所占比例很低
国产疫苗占上市疫苗主体,支撑国家免疫规划实施。2016 年,申请疫苗批签发的国内企业 33 家。签发国产疫苗 3808 批、计 6.31 亿人份;进口疫苗 141 批、计 0.15 亿人份。
历年进口疫苗量仅占上市疫苗的 5%以下,近两年所占比例又有所减低,仅占上市疫苗的2.1-2.3%。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

