中商情报网讯:非临床研究指药物研发研究,并非以人为受试对象进行的临床试验。该等非临床研究涵盖药物研发过程的所有重要阶段,包括药物发现、临床前及临床试验阶段。药物非临床安全性评价(DSA)提供安全性数据,并为就候选药物设计首次人体临床试验奠定基础。
市场规模
中国的非临床DSA市场的总收益于2015年约为138.0百万美元,并于2019年增至415.7百万美元,复合年增长率为31.7%,远高于全球市场的复合年增长率。中国的非临床DSA市场预计将在未来五年保持快速增长,2021年达至831.9百万美元,复合年增长率为36.5%。
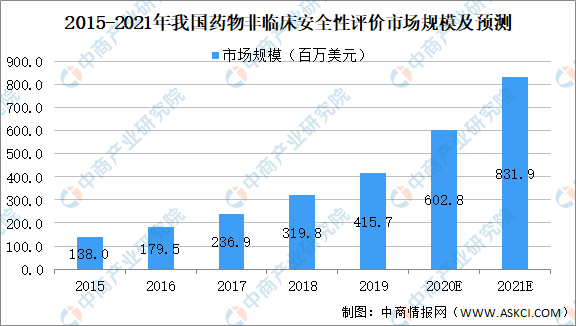
数据来源:中商产业研究院整理
未来发展趋势
1.协同效应
由于非临床DSA组织对候选药物进行临床前评价,其积累有关候选药物的机构经验和知识,并在设计和分析后续的临床试验时处于有利地位。通过提供临床研发服务,DSA组织为客户提供无缝一站式体验以减少各种交易成本,从而为其提供有说服力的价值主张。此外,DSA组织因协调研发流程及利用其对候选药物试验的机构知识和经验而实现更好的协同效应。
2.增值服务
专业团队对潜在药物的特性、安全性风险和危害有深刻的了解。因此,可就开展DSA向客户提供见解,包括全面的药物评价和后续研发建议,也可以有效的协助企业与客户建立良好的关系。
3.行业整合
在我国,仅少数几家具有较强能力提供符合国际标准的综合服务的领先合同研究组织才能推动行业的发展。对于规模较小的市场参与者来说,通过为主要客户开展日益复杂的项目来获得市场份额变得越来越困难。因此,预期非临床DSA行业将在未来进行整合,且领先的参与者预期将收购该行业中规模较小的参与者。
未来发展前景
1.规范审批流程,提高效率
中国政府已经发布多项监管政策,以进一步规范新药临床试验申请审批流程。随着治疗性及预防性生物制剂药物非临床安全性评价详细指导方针的出台,中国药物非临床安全性评价日趋严格,符合人用药品注册技术要求国际协调会议的国际标准。因此,多年来,药物非临床安全性评价流程的整体效率一直在提高。
2.不断增长的创新药市场
中国制药行业正处于从仿制药转向创新药的战略转型期,且创新药市场呈现出良好的增长态势。与仿制药和生物类似药不同,创新药需要进行非临床安全性评价。随着创新药制剂的发展,非常规给药途径的范围将扩大,例如通过眼睛、耳朵和鼻腔等特殊途径给药。因此,非临床DSA服务提供商须拥有更强的药物安全性评价实力。有关服务的发展将成为非临床DSA行业的主要驱动因素。
3.不断扩大的生物制剂市场
生物制剂对包括癌症和慢性疾病在内的各类病症具有出色的治疗效果。中国的生物制剂市场正在迅速扩大,其复合年增长率领先于整个制药市场。由于特殊的结构及特性,特别是细胞及基因疗法,生物制剂具有特殊性及复杂性。因此,用于化学药品的常规和常见非临床DSA可能不完全适用于生物制剂。例如,用于基因和细胞疗法的非临床DSA包括对单次及重复给药毒性试验及免疫原性试验进行的评价以及其他评价类型。
更多资料请参考中商产业研究院发布的《中国药物非临床安全性评价行业市场前景及投资机会研究报告》,同时中商产业研究院还提供产业大数据、产业情报、产业研究报告、产业规划、园区规划、十四五规划、产业招商引资等服务。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

